Trypsin dan chymotrypsin adalah dua enzim kunci dalam pencernaan protein makanan. Keduanya diproduksi dan disekresikan sebagai zymogen, yaitu dalam bentuk tidak aktif, oleh pankreas; prekursor zymogen dari trypsin disebut trypsinogen, sedangkan chymotrypsin disebut chymotrypsinogen.
Trypsin dan chymotrypsin milik keluarga besar enzim proteolitik (yang terlibat dalam pencernaan protein) dan subkelompok endopeptidase. Zat-zat ini - termasuk pepsin lambung dan elastase pankreas - menyerang ikatan peptida dalam rantai asam amino, sehingga menimbulkan fragmen molekul yang lebih kecil. Enzim-enzim yang termasuk dalam kelompok kedua, yaitu dari exopeptidases, menyelesaikan kerja trypsin dan chymotrypsin, memisahkan asam amino individu dari ujung rantai peptida; Karboksipeptidase pankreas (A1, A2 dan B, yang menyerang ujung karboksil) milik keluarga ini, tetapi juga aminopeptidase (yang menyerang ujung aminoterminal) dan dipeptidase, keduanya diproduksi dan dikeluarkan oleh mukosa usus halus. Beberapa karboksipeptidase, mirip dengan yang terlihat untuk trypsin (trypsinogen) dan chymotrypsin (chymotrypsinogen), disekresikan oleh pankreas dalam bentuk tidak aktif. Dalam ketiga kasus tersebut enzim yang terlibat dalam proses aktivasi enzimatik adalah enteropeptidase, protein yang diproduksi dan disekresikan oleh sel-sel mukosa duodenum; lebih khusus lagi, enteropeptidase khusus untuk trypsinogen, yang pernah dikonversi menjadi trypsin juga mengaktifkan enzim proteolitik lainnya, termasuk trypsinogen itu sendiri.
Perbedaan fungsional antara trypsin dan chymotrypsin hanya menyangkut kekhususan mereka, yaitu kemampuan untuk mengenali dan memecah hanya ikatan yang dibentuk oleh asam amino yang terdefinisi dengan baik. Trypsin mengintervensi terutama pada ikatan peptida yang melibatkan asam amino basa (seperti arginin dan lisin), sementara chymotrypsin menghidrolisis terutama ikatan yang melibatkan tirosin, fenilalanin, triptofan, leusin dan metionin.
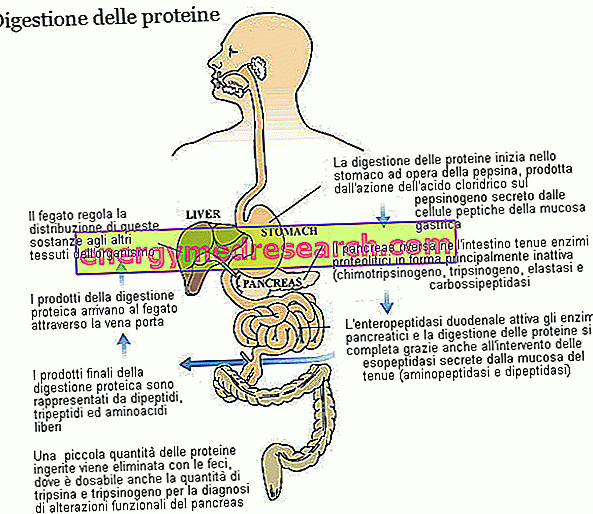
Berkat berbagai enzim proteolitik, dengan kontribusi keasaman lambung, protein diet - awalnya dibentuk oleh beberapa puluh asam amino - dipecah menjadi dipeptida, tripeptida dan asam amino bebas, semua zat yang mudah diserap yang berasal dari kapiler mukosa usus datang diangkut ke hati.
Tripsin dan chymotripsin dalam feses
Penentuan chymotrypsin dan trypsin dalam tinja digunakan, dan terutama demikian di masa lalu, sebagai tes tidak langsung dari kapasitas fungsional pankreas eksokrin. Jika sesuatu tidak berfungsi dengan baik pada tingkat kelenjar ini, masuk akal untuk mengharapkan berkurangnya sintesis trypsin dan chymotrypsin, yang juga akan kekurangan feses. Tes memiliki sensitivitas yang baik, tetapi dibebani oleh risiko nyata positif palsu dan negatif palsu. Penggunaan obat pencahar, misalnya, mengurangi konsentrasi enzim dalam bahan tinja, sedangkan asupan ekstrak pankreas pencernaan (seperti pancreatin) atau sayuran (misalnya tangkai nanas, pepaya, papain dan bromelain) menyebabkan hasil negatif palsu. Juga flora bakteri usus sedikit memengaruhi jumlah trypsin dan chymotrypsin yang tiba tidak berubah di dalam feses; untuk alasan ini penggunaan antibiotik dapat menghasilkan negatif palsu; sebaliknya, dengan adanya divertikulosis dan kondisi lain yang mendukung proliferasi bakteri, hasil positif palsu dapat dicatat.
Aplikasi klasik dari dosis trypsin dan chymotrypsin dalam feses adalah deteksi kekurangan pankreas pada pasien dengan cystic fibrosis. Salah satu konsekuensi dari penyakit ini adalah gangguan transportasi normal trypsin dan enzim pencernaan lainnya dari pankreas ke duodenum; untuk alasan ini, saat lahir, kotoran anak dengan fibrosis kistik sangat padat, sampai menyebabkan obstruksi usus. Akibatnya, sejumlah kecil chymotrypsin dan trypsin dicatat dalam meconium.



