Apa itu DepoCyte?
DepoCyte adalah suspensi untuk injeksi yang mengandung 50 mg zat aktif cytarabine.
Untuk apa DepoCyte digunakan?
DepoCyte digunakan dalam pengobatan meningitis limfomatous, penyakit di mana sel-sel tumor kelenjar getah bening menyebar ke cairan tulang belakang, ke membran yang menutupi otak dan sumsum tulang belakang (meninges). DepoCyte membantu mengendalikan gejala penyakit. Obatnya hanya bisa didapat dengan resep dokter.
Bagaimana DepoCyte digunakan?
Perawatan dengan DepoCyte hanya boleh dimulai oleh dokter berpengalaman dalam pemberian obat-obatan antikanker. Pemberian berlangsung melalui suntikan "deposit" (sejenis suntikan di mana obat disiapkan sehingga diserap sangat lambat oleh tubuh). Obat harus disuntikkan langsung ke cairan tulang belakang (injeksi intratekal: tusukan di ruang sekitar sumsum tulang belakang dan otak). Pada saat yang sama, steroid (deksametason) juga harus diberikan kepada pasien untuk mengendalikan beberapa efek samping obat.
DepoCyte pada awalnya diberikan sebagai injeksi 50 mg setiap dua minggu untuk lima dosis pertama, diikuti oleh dosis 50 mg lainnya empat minggu kemudian, dan kemudian dengan empat dosis pemeliharaan 50 mg setiap empat minggu. Dosis dapat dikurangi menjadi 25 mg jika pasien menunjukkan gejala neurotoksisitas (sakit kepala, penglihatan abnormal, atau kelemahan atau nyeri otot).
Bagaimana cara kerja DepoCyte?
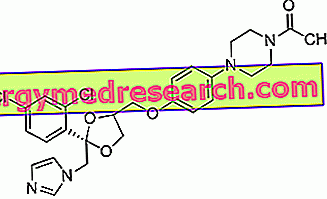
Bahan aktif dalam DepoCyte, cytarabine (juga dikenal sebagai ara-C), adalah agen anti-tumor yang digunakan sejak tahun 1970. Ini adalah obat sitotoksik (zat yang membunuh sel pembagi aktif, seperti sel kanker) milik kelompok antimetabolit.
Sitarabin adalah analog pirimidin. Pirimidin adalah komponen materi genetik sel (DNA dan RNA). Di dalam tubuh, cytarabine menggantikan pirimidin dan mengganggu enzim yang terlibat dalam sintesis DNA. Dengan cara ini, sitarabin menghambat pertumbuhan sel tumor sampai dihancurkan. Dalam DepoCyte, cytarabine hadir dalam formulasi khusus: bahan aktif, yaitu, terkandung dalam liposom (partikel lemak kecil), dari mana ia perlahan dilepaskan.
Bagaimana DepoCyte dipelajari?
Efek DepoCyte pertama kali dianalisis dalam model eksperimental sebelum dipelajari pada manusia. Studi utama dilakukan pada 35 pasien dan membandingkan pemberian DepoCyte intratekal dengan formulasi sitarabin standar. Studi ini mengukur respon pasien terhadap pengobatan (tidak adanya sel-sel tumor dalam fludo tulang belakang) dan memburuknya gangguan saraf yang mereka terpengaruh (gejala sistem saraf).
Apa manfaat yang ditunjukkan oleh DepoCyte selama studi?
13 dari 18 pasien yang diobati dengan DepoCyte menanggapi pengobatan, menyebabkan pengangkatan sel tumor dari cairan tulang belakang, sementara di antara 17 pasien yang menerima formulasi standar, hanya 3 yang menanggapi pengobatan. Namun, tidak ada perbedaan yang dicatat antara kedua obat sehubungan dengan lamanya periode remisi, di mana pasien mengalami perburukan gangguan saraf.
Apa risiko yang terkait dengan DepoCyte?
Efek samping yang paling umum (diamati dalam persentase mulai dari 10 hingga 25% dari siklus pengobatan) adalah sakit kepala, mual, muntah, demam dan sakit punggung. Terlebih DepoCyte dapat mendukung timbulnya arachnoiditis (radang arachnoid, salah satu membran yang melindungi tulang belakang dan otak). Untuk meminimalkan efek samping pada pasien, ditempatkan di bawah pengawasan medis, steroid (oral atau injeksi) harus diberikan pada saat injeksi DepoCyte. Untuk daftar lengkap semua efek samping yang dilaporkan dengan DepoCyte, lihat Leaflet Paket.
DepoCyte tidak boleh digunakan pada orang yang mungkin hipersensitif (alergi) terhadap sitarabin atau zat lainnya. Obat tidak boleh diberikan kepada pasien dengan infeksi aktif pada meninges.
Mengapa DepoCyte disetujui?
Komite Produk Obat untuk Penggunaan Manusia (CHMP) telah menemukan DepoCyte menjadi efektif dalam pengobatan meningitis limfomatosa dibandingkan dengan perumusan standar citabirin dan bahwa program administrasi, dengan suntikan intratekal yang lebih sedikit, dapat meningkatkan kualitas hidup. pasien. CHMP memutuskan bahwa manfaat DepoCyte lebih besar daripada risikonya dan karena itu merekomendasikan agar diberikan otorisasi pemasaran.
Informasi lebih lanjut tentang DepoCyte:
Pada 11 Juli 2001, Komisi Eropa mengeluarkan otorisasi pemasaran untuk DepoCyte, yang berlaku di seluruh Uni Eropa. Otorisasi diperbarui pada 11 Juli 2006. Pemegang otorisasi pemasaran adalah Pacira Limited.
Untuk versi lengkap DepoCyte Epar klik di sini.
Pembaruan terakhir dari ringkasan ini: Juli 2007